Wie und wie schnell ändern Feststoffe ihre Zusammensetzung?
Forschungsbericht (importiert) 2018 - Max-Planck-Institut für Festkörperforschung
Feststoffe können – innerhalb gewisser Grenzen – ihre Zusammensetzung ändern. Da in diesem zumeist sehr kleinen Bereich die Konzentrationen der ionischen und elektronischen Ladungsträger über Größenordnungen variieren, ist dieser Prozess nicht nur von grundlegendem Interesse, sondern auch für Anwendungen wie Sensoren, Brennstoffzellen und Batterien von großer Relevanz. Das Verständnis der Kinetik solcher Zusammensetzungsänderungen ist Voraussetzung für eine gezielte Funktionseinstellung.
In Festkörpern sind Punktdefekte wie Leerstellen oder Zwischengitterionen nicht nur für deren ionische Leitfähigkeit verantwortlich, sie bestimmen auch die Kinetik der Änderung der chemischen Zusammensetzung. Diese Fragestellung ist eines der Hauptarbeitsgebiete unserer Abteilung, die sich von Katalyse bis zu chemischen Reaktionen in Mehrphasensystemen erstrecken.
Die Aufnahme eines Elements wie Sauerstoff, Wasserstoff oder Lithium in einen Feststoff durch Einbau in ein bestehendes Kristallgitter stellt den einfachsten Fall dar. Dabei bleibt die Struktur der Phase erhalten, und nur die chemische Zusammensetzung (δ) verändert sich. Trotzdem ist bereits dieser nominell simple Prozess äußerst komplex. Betrachten wir an dieser Stelle den Sauerstoffeinbau in ein Oxid MO1-δ, wodurch sich das Sauerstoffdefizit δ um den Betrag Δδ ändert. Ungeachtet der Details sind zwei aufeinanderfolgende Prozesse zu unterscheiden: die Oberflächenreaktion, und die Diffusion innerhalb des Materials. Die Oberflächenreaktion umfasst die Aufspaltung der Moleküle, die Elektronenübertragung und den Transfer der gebildeten Ionen von der Oberfläche in den Festkörper. Direkt unter der Oberfläche können Raumladungseffekte eine wichtige Rolle spielen. Wir haben im Lauf der Jahre gezeigt, dass eine wohlkonzipierte Kombination von theoretischen und experimentellen Ansätzen genügend Information liefert, um den Mechanismus auch komplexer Reaktionen aufzuklären. Hierbei treten folgende Charakteristika zu Tage:
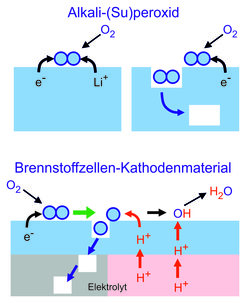
Sauerstoffaustausch an Superoxiden und Peroxiden (oben, ohne Aufspaltung des Sauerstoffmoleküls), und an Oxiden, die als Elektrode an der Luftseite von keramischen Brennstoffzellen fungieren (unten, häufig bestimmt die mit grünem Pfeil dargestellte Dissoziation die Reaktionsgeschwindigkeit).
Ungeachtet der Komplexität des genauen Ablaufs tragen typischerweise zwei Prozesse zum ratenbestimmenden Schritt der Sauerstoffeinbaureaktion bei: (i) die Dissoziation des (mehr oder weniger) geladenen Sauerstoffmoleküls und (ii) die Verfügbarkeit von Sauerstoffleerstellen, die die Dissoziation erleichtern und für den Einbau benötigt werden (siehe Abb. 1). Wegen der geringen Mobilität des adsorbierten Sauerstoffs obliegt es der Leerstelle, den adsorbierten Sauerstoff zu „finden“. Unter Verwendung der Leerstellen-Beweglichkeit als Suchkriterium konnten wir exzellente Katalysatoren für die Sauerstoff-Reduktionreaktion in Brennstoffzellen identifizieren. Während sich in Hochtemperatur-Brennstoffzellen die eingebauten Oxidionen durch den Elektrolyten bewegen, wird in protonenleitenden Brennstoffzellen der Sauerstoff unter Aufnahme von Protonen aus dem Elektrolyten zu Wasser reduziert. Interessanterweise findet die Protonenübertragung erst nach dem ratenbestimmenden Schritt statt, sodass die Kinetik in beiden Zelltypen sehr ähnlich ist.
Ein besonders aufschlussreicher Fall liegt beim Sauerstoffeinbau in Superoxide und Peroxide vor, die molekulare Sauerstoffionen enthalten. Hierbei muss das hantelförmige Sauerstoffmolekül nicht aufgespalten werden, was zu hohen Reaktionsraten führt, insbesondere für Kaliumsuperoxid KO2 [1].
Wenn wir statt der stationären Situation in Brennstoffzellen die Kinetik der Stöchiometrieänderung betrachten, ist auch der Sauerstofftransport im Inneren des Festkörpers nicht trivial. Dieser Transport ist ein chemischer Diffusionsprozess, der die gekoppelte Bewegung von Ionen und Elektronen benötigt. Des Weiteren sind diese Transportprozesse typischerweise an interne Wechselwirkungen angekoppelt. Wir konnten zeigen, dass die chemischen Diffusionskoeffizienten über viele Größenordnungen hinweg sehr genau beschrieben werden können, wenn die zugrundeliegenden Materialparameter bekannt sind. Die Transportprozesse lassen sich mit hoher Genauigkeit beschreiben, selbst wenn innere Grenzflächen eine entscheidende Rolle spielen. Solche Systeme stehen im Fokus eines anderen Arbeitsgebietes unserer Abteilung, der "Nano-Ionik", die jedoch nicht im Zentrum dieses Berichts steht.
Wir wollen stattdessen die Komplexität des eingebauten Moleküls erhöhen und uns dem Wassereinbau zuwenden: Dieser Einbau kann in Oxiden stattfinden, wobei die (durch Akzeptordotierung erzeugten) Sauerstoffleerstellen durch Hydroxidionen (OH-) gefüllt und durch die verbleibenden Protonen (H+) durch Anlagerungen an Oxidionen in zusätzliche OH– umgewandelt werden. Die gebildeten OH–-Ionen sind für die Protonenleitfähigkeit solcher hydratisierten Oxide verantwortlich. Analog zum Sauerstoffeinbau, welcher durch Diffusion von Oxidionen und Elektronen ermöglicht wird, sollte der Wasserstoffeinbau durch gekoppelte Wanderung von H+ und O2– realisiert werden. Im zweiten Fall erwartet man keine starken Redoxeffekte und somit keine starken Veränderungen der elektronischen Leitfähigkeit.
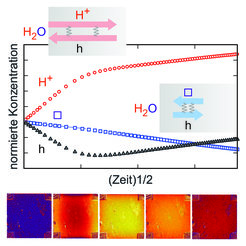
Überraschenderweise wird der Wassereinbau jedoch von ausgeprägten Redox- und Farbwechseleffekten begleitet [2,3]. Die Probe verhält sich, als würde sie einer Wasserstoff- und danach einer Sauerstoffatmosphäre ausgesetzt. Der Grund für dieses nicht-monotone Verhalten liegt in der höheren Komplexität durch Beteiligung von drei Ladungsträgern: die leichtbeweglichen H+-Ionen werden nicht von den trägeren O2–-Ionen begleitet, sondern von den schnellen Elektronen; erst in einem langsameren Schritt wird diese Reduktion durch gekoppelte Diffusion von O2– und e– weitgehend wieder ausgebügelt (siehe Abb. 2).
Allerdings reichen für eine vollständige Beschreibung einer solch komplexen Kinetik zwei Diffusionskoeffizienten nicht aus, insgesamt werden vier benötigt. Wir konnten diese Vorgänge exakt beschreiben [2]. Die auftretenden Transportparameter sind durch Beweglichkeiten und Konzentrationen der beteiligten Ladungsträger gegeben. Diese sind für unser Modellmaterial wie SrTiO3 bekannt; damit lassen sich solche komplexen Prozesse weitreichend und erstaunlich detailliert beschreiben.
Eine der Sauerstoffinkorporation verwandte Situation ergibt sich für den Einbau von Lithium oder Natrium in Elektrodenmaterialien moderner Batterien [4]. Während die Diffusionsprozesse ähnlich sind, unterscheidet sich die Reaktion an Grenzflächen allerdings drastisch. Insbesondere zeigt es sich, dass hier Grenzflächen nicht nur bezüglich des Transports wichtig sind, sie können auch neuartige Mechanismen der chemischen Speicherung eröffnen [5].
Diese Beispiele demonstrieren eindrucksvoll, wie gut die chemische Kinetik von Festkörpern verstanden werden kann, wenn – und nur wenn – man die Defektchemie von Punktfehlern, das heißt der „chemisch angeregten Zustände“, entsprechend berücksichtigt.

